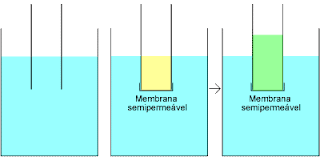
Para entender a "osmose reversa", vamos começar compreendendo a osmose normal. De acordo com o Merriam-Webster's Collegiate Dictionary, a definição de osmose é "o movimento de um solvente através de uma membrana semipermeável (como a de uma célula viva) para uma solução com maior concentração de soluto. Este movimento tem como objetivo balancear a concentração de soluto nos dois lados da membrana". Isso soa bem. Mas para entender o que tudo isso significa, esta figura é mais útil:
Na esquerda, existe um becker cheio de água e um tubo parcialmente submerso na água. O nível de água no tubo é o mesmo nível de água no becker. Na figura central, a extremidade do tubo foi selada com uma "membrana semipermeável" e metade do conteúdo do tubo foi preenchido por uma solução com sal. Inicialmente, os níveis da solução com sal e de água são iguais, mas com o tempo algo inesperado acontece: o nível da água no tubo começa a subir. Esse aumento é causado pela "pressão osmótica".
Uma membrana semipermeável é uma membrana que deixa passar alguns átomos ou moléculas, mas outros não. O polímero é uma membrana, mas é impermeável a quase tudo que conhecemos. O exemplo mais comum de membrana semipermeável é o seu intestino ou as paredes celulares que o formam. Gore-tex é outro tipo de membrana semipermeável. Esta membrana é formada por uma camada de filme plástico extremamente fino, com bilhões de pequenos poros. Os poros são grandes o suficiente para deixar o vapor d'água passar, mas pequenos o suficiente para impedir a passagem da água em estado líquido. Veja esta página (em inglês) para mais informações sobre o Gore-tex).
Na figura acima, a membrana permite a passagem de moléculas de água, mas não deixa passar as moléculas de sal. Uma maneira de entender a pressão osmótica é pensando nas moléculas de água em ambos os lados da membrana. Elas estão constantemente em movimento browniano (em inglês). No lado da solução com sal, alguns dos poros são preenchidos com átomos de sal, mas no lado da água pura, isto não acontece. Por isso, mais água passa do lado da água pura para o lado da solução com sal, já que existem mais poros no lado da água pura para que as moléculas de água passem. O nível de água no lado da solução com sal aumenta até que umas destas duas coisas aconteça:
* a concentração de sal se torne a mesma nos dois lados da membrana (o que não vai acontecer neste caso, já que existe água pura de um lado e água salgada do outro);
* a pressão da água aumente, ao mesmo tempo em que a coluna de água salgada aumenta, até que se iguale à pressão osmótica. Neste ponto, a osmose pára.
Se você engolir água salgada (como a água do mar), é a osmose que vai te matar. Quando a água salgada entra no seu estômago, a pressão osmótica faz com que a água comece a sair do seu corpo para tentar diluir o sal que está no estômago. Conseqüentemente, você vai ficar desidratado e morrer.
Na osmose reversa, a idéia é usar a membrana como um filtro extremamente fino para transformar a água salgada (ou contaminada) em água potável. A água salgada é colocada de um lado da membrana e uma pressão é aplicada para parar e depois reverter a pressão osmótica. Geralmente é necessário aplicar uma pressão muito grande e o processo é bastante demorado, mas funciona.
Nenhum comentário:
Postar um comentário